Tình hình sản xuất và tiêu thụ
Vết thương cấp tính và mạn tính ảnh hưởng khá lớn đến sức khỏe, đời sống con người và kinh tế của quốc gia. Vết thương mạn tính bắt nguồn từ nhiều nguyên nhân khác nhau như vết loét do tĩnh mạch, loét do bệnh đái tháo đường, do tì đè, do xạ trị,… Nếu vết thương không được chăm sóc đầy đủ sẽ dẫn đến tình trạng khó liền, để lại nhiều di chứng, biến chứng nặng nề, và gây ra nhiều tốn kém về chi phí điều trị.
Theo các bác sĩ chuyên khoa và các bác sĩ điều trị, bệnh nhân có vết thương lâu lành, nhu cầu chăm sóc và điều trị vết thương hiện nay tại Việt Nam là rất lớn. Theo thống kê của Khoa Liền vết thương - Viện Bỏng Quốc gia vào năm 2014 trên 430 bệnh nhân được theo dõi, số bệnh nhân mang vết thương mạn tính chiếm tỷ lệ khá lớn so với các vết thương thông thường (87,67% so với 12,33%).
Việc điều trị vết thương mạn tính không chỉ bao gồm các biện pháp chăm sóc vết thương cơ bản như kiểm soát vết thương, kiểm soát nhiễm trùng, kiểm soát áp lực, kiểm soát mạch máu, mà còn bao gồm các biện pháp chăm sóc chuyên sâu như sử dụng yếu tố tăng trưởng, tế bào gốc, liệu pháp gen,… Trong đó, rhPDGF-BB (nhân tố tăng trưởng từ tiểu cầu người dạng BB tái tổ hợp) hay còn gọi là becaplermin là sản phẩm đầu tiên được tổ chức FDA (Mỹ) cấp phép sử dụng trong điều trị loét chi ở bệnh nhân đái tháo đường.
Tuy nhiên, việc ứng dụng rhPDGF-BB trong điều trị ở Việt Nam còn hạn chế; giá thành của các sản phẩm chăm sóc chuyên sâu còn cao so với thu nhập trung bình của người dân ở nước ta. Do đó, vẫn còn nhiều bệnh nhân phải chấp nhận sống chung với vết thương đến hết đời, thậm chí dẫn đến đoạn chi hay gây tử vong.
Vì vậy, việc nghiên cứu sản xuất nguyên liệu rhPDGF-BB tái tổ hợp trong nước và bào chế thuốc điều trị vết thương dựa trên nguyên liệu này sẽ tạo ra sản phẩm điều trị vết thương với giá thành hợp lý, mang lại ý nghĩa kinh tế xã hội và nhiều lợi ích cho bệnh nhân.
Quy trình và phương pháp thực hiện
Quy trình tinh chế thu nhận nguyên liệu rhPDGF-BB đáp ứng quy mô sản xuất 1000 tuýp gel bôi
Quy trình này tinh chế rhPDGF-BB bằng sắc ký trao đổi cation trên cột tự nhồi 400ml sử dụng phương pháp dung ly gradient và phương pháp dung ly stepwise, thu được trung bình 3,08g rhPDGF-BB có độ tinh sạch ≥95%.

+ Quy trình tinh chế dung ly gradient trên cột 400ml như sau:
- Mẫu được lọc qua giấy lọc để loại bỏ các cặn lớn, điều chỉnh pH về pH 4,0 bằng acid acetic 100%, độ dẫn điện nhỏ hơn 30mS/cm bằng cách làm loãng với nước cất.
- Cân bằng cột bằng 3 – 5 CV (Column Volume) dung dịch A. Lưu lượng dòng sử dụng xuyên suốt trong quá trình tinh chế là 150ml/phút. Nạp vào cột tinh chế mẫu dịch lên men tương ứng chứa 0,6 g PDGF-BB. Rửa các protein không bám cột bằng 3 CV dung dịch A.
- Dung ly gradient bằng cách tăng dần nồng độ dung dịch B (NaCl 1 M trong Tris-HCl 20mM pH 7,5) từ 1 đến 100% để dung ly protein. Thu nhận mỗi phân đoạn 160ml chứa 2% B.
- Các phân đoạn sau khi tinh chế được giữ lại và phân tích dưới gel điện di SDSPAGE (Sodium Dodecyl Sulfate – Polyacrylamide Gel Electrophoresis), hiện protein bằng phương pháp nhuộm bạc. Từ gel này, sử dụng phần mềm Gel Analyzer để phân tích tỷ lệ protein mục tiêu trong các dịch thu nhận được.
- Ở giai đoạn tinh chế dung ly gradient, bước dung ly được tiến hành với 100 phân đoạn từ 1 đến 100% B, mỗi phân đoạn chứa 80ml. Sau 3 lần thực hiện, có thể thấy protein mục tiêu bám cột tốt khi mẫu qua cột và mẫu rửa không chứa protein này. Khi bắt đầu tăng dần nồng độ dung dịch dung ly, rhPDGF-BB bắt đầu bị đẩy ra ở phân đoạn trong khoảng 50 – 95% dung dịch B. Protein tinh chế có độ tinh sạch trên 95%. Kết quả này được sử dụng để thiết lập quy trình tinh chế dung ly stepwise.
+ Quy trình tinh chế dung ly stepwise được thực hiện tương tự như quy trình tinh chế dung ly gradient, ngoại trừ:
- Rửa protein không bám cột bằng 5 CV 45% dung dịch B
- Dung ly bằng 5 CV 90% dung dịch B
- Rửa lại cột bằng 5 CV 100% dung dịch B
- Dịch lên men chứa khoảng 6g rhPDGF-BB được tinh chế dung ly stepwise, thay bước rửa từ 0% B thành 45% B, dung ly trực tiếp tại 85% B thay vì dung ly tăng dần từ 0 đến 100% B như ở quy trình dung ly gradient. Sau 3 lần thực hiện, mẫu qua cột (mẫu F) và mẫu rửa (mẫu W) không có xuất hiện protein mục tiêu, cho thấy rhPDGF-BB bám cột rất tốt.
- Từ lượng khoảng 6g protein rhPDGF-BB được sử dụng trong 3 lần tinh chế dung ly stepwise (lần lượt là 5,64g, 6,02g và 5,98g), quy trình tinh chế đã thu hồi được trung bình 3,08 ± 0,16g protein rhPDGF-BB/mẻ tinh chế, hiệu suất tinh chế trung bình ở mức 52,5%.
Quy trình sản xuất gel becaplermin (rhPDGF-BB) 0,01%
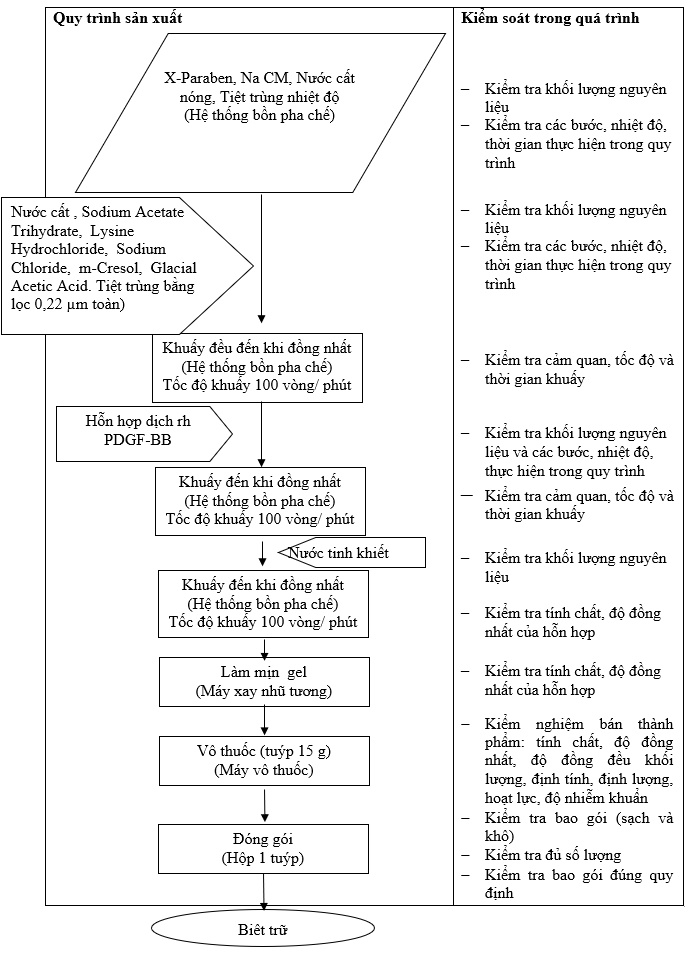
Mô tả quy trình:
a. Chuẩn bị dung dịch hoạt chất:
Nguyên liệu đông lạnh được rã đông và gộp lại trong bình chứa thủy tinh, bảo quản ở 2-8°C. Nhìn chung, nguyên liệu đã rã đông có thể được giữ ở 2-8°C trong 24-48 giờ (tối đa tổng cộng 18 ngày chia làm nhiều đợt) và tái đông tối đa 3 lần (nếu cần).
Kiểm tra nồng độ protein bằng A280nm.
b. Pha chế gel:
Dụng cụ bồn pha chế vô trùng. Pha 27g X-Paraben trong 7,5kg nước cất đun sôi trong 30 phút, thêm 360g sodium carboxymethycellulose. Duy trì nhiệt độ 80°C cho trương nở hoàn toàn. Hạ nhiệt độ xuống 8°C. Kiểm tra và điều chỉnh pH đến 5,0.

Gel rhPDGF-BB 0,01% bào chế.
c. Trộn hoàn tất:
Dụng cụ thùng inox vô trùng. Cho 4,5 kg nước cất đun sôi 30 phút, 24,5g đệm acetate, 75g lysine hydrochloride, 121,29g sodium chloride, 13,5g m-cresol. Hạ nhiệt độ xuống 8°C, cho vào bồn chứa gel. Khuấy bồn pha chế chứa gel liên tục đến khi đồng nhất, tốc độ 100 vòng/phút. Duy trì nhiệt độ khuấy 2-8°C. Thêm từ từ dung dịch hoạt chất vào, cho chậm, vừa cho vừa khuấy phân tán hoàn toàn. Thêm 2,381kg nước cất vô trùng vào. Khuấy đồng nhất.
Cho vào máy xay nhũ tương.
d. Vô thuốc và đóng gói: vô thuốc tuýp 15g. Độ đồng đều khối lượng 15g ± 10%.
e. Kiểm nghiệm bán thành phẩm: tính chất, độ đồng đều khối lượng, độ đồng nhất, định tính, định lượng, thử giới hạn nhiễm khuẩn.
f. Đóng gói vào hộp: 1 tuýp 15g có nhãn ghi đúng quy chế dược chính. Ngày sản xuất được tính theo ngày vô thuốc vào tuýp.
g. Bảo quản:
Đưa về kho, bảo quản: điều kiện dài hạn (điều kiện thực) 5°C ± 3°C (2-8°C), điều kiện già hóa (cấp tốc) 25°C ± 2°C (23-27°C), độ ẩm 60 ± 5%.
Đóng nắp tuýp ngay sau khi dùng.
h. Hạn dùng: 1 năm. Sử dụng trong vòng 2 tuần kể từ khi mở tuýp.
Ưu điểm của công nghệ, hiệu quả kinh tế
Quy trình sản xuất nguyên liệu rhPDGF-BB và quy trình bào chế gel becaplermin (rhPDGF-BB) 0,01% đã được khảo sát và tối ưu, áp dụng ở quy mô sản xuất 1000 tuýp gel bôi (15g/tuýp, 0,01% rhPDGF-BB).
Nguyên liệu rhPDGF-BB và chế phẩm gel becaplermin 0,01% đạt tiêu chuẩn cơ sở, đã được xây dựng bộ tiêu chuẩn kiểm nghiệm nguyên liệu dựa trên Dược điển Việt Nam V và Dược điển Mỹ USP40. Trong đó phương pháp đánh giá hoạt lực sinh học đã được thẩm định.
Sản phẩm thuốc thành phẩm.
Chế phẩm gel rhPDGF-BB 0,01% được kiểm tra tính an toàn, không gây kích ứng da và có khả năng làm lành vết thương hiệu quả trên mô hình chuột đái tháo đường. Chế phẩm gel rhPDGF-BB 0,01% đã được Công ty CP Dược phẩm dược liệu Pharmedic khảo sát sơ bộ về nhu cầu thị trường cho thấy khả năng ứng dụng vào sản xuất kinh doanh cao.
Hiện nay, việc ứng dụng rhPDGF-BB trong điều trị ở Việt Nam còn hạn chế do giá thành của sản phẩm này khá đắt tiền (khoảng 1000 USD cho 1 tuýp thuốc Regranex 15g). Quy trình sản xuất nguyên liệu và quy trình bào chế gel rhPDGF-BB 0,01% có thể triển khai sản xuất ở quy mô lớn và tiến hành thương mại hóa, giảm giá thành sản phẩm, đáp ứng nhu cầu sử dụng chế phẩm gel rhPDGF-BB 0,01% trong điều trị các vết thương mạn tính và khó lành. Dự kiến giá thành của sản phẩm sản xuất trong nước vào khoảng 50 – 100 USD/tuýp. Tuy nhiên, để sản phẩm có thể thương mại hóa, các thử nghiệm lâm sàng nhằm đánh giá tính an toàn và hiệu quả điều trị trên người cần được đầu tư tiến hành.
Thông tin chuyên gia, hỗ trợ
1. TS. Nguyễn Trí Nhân
Điện thoại: 0913119183
Email: ntrnhan@hcmus.edu.vn
2. Trường Đại học Khoa học Tự nhiên, ĐHQG-HCM
Địa chỉ: 227 Nguyễn Văn Cừ, phường 4, quận 5, TP.HCM. Điện thoại: 028 38353193.
3.Trung tâm Thông tin và Thống kê Khoa học và Công nghệ - Phòng Giao dịch Công nghệ
79 Trương Định, P. Bến Thành, Q.1, TP. HCM
ĐT: (028) 3822 1635 - Fax: (028) 3829 1957
Email: pgdcn@cesti.gov.vn
Lam Vân (CESTI)